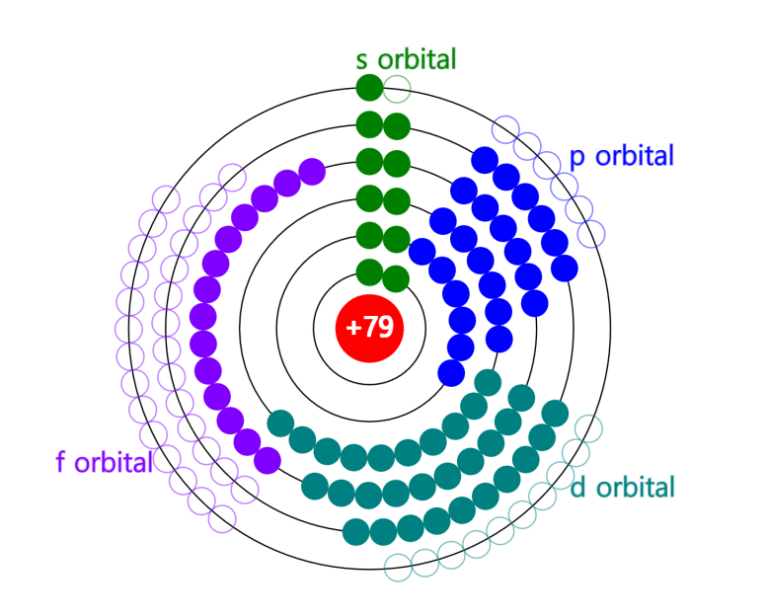
✅ Para saber cuántos electrones tiene un elemento químico, mirá su número atómico: ese número impactante indica la cantidad exacta de electrones.
Para saber cuántos electrones tiene un elemento químico, es fundamental entender primero que el número de electrones en un átomo neutro es igual al número atómico del elemento. El número atómico, representado con la letra Z, indica la cantidad de protones en el núcleo del átomo y, en consecuencia, la cantidad de electrones que orbitan alrededor del núcleo en un estado neutro.
Te explicaremos detalladamente cómo identificar la cantidad de electrones en un elemento químico a partir de su número atómico, además de considerar casos especiales como iones o átomos con carga. También brindaremos ejemplos prácticos y consejos para interpretar la tabla periódica y comprender mejor la estructura electrónica de los elementos.
¿Qué es el número atómico y cómo se relaciona con los electrones?
El número atómico es un valor único para cada elemento químico y se representa con la letra Z. Este número indica la cantidad de protones en el núcleo del átomo. Para un átomo neutro, la cantidad de electrones es igual a la de protones, porque las cargas positivas y negativas se equilibran.
- Elemento neutro: Electrones = Número atómico (Z)
- Ión positivo (catión): Electrones = Z – carga positiva
- Ión negativo (anión): Electrones = Z + carga negativa
Ejemplos prácticos de cálculo de electrones
Veamos cómo determinar la cantidad de electrones en algunos ejemplos:
- Oxígeno (O): Tiene un número atómico de 8. Por lo tanto, un átomo neutro de oxígeno tiene 8 electrones.
- Sodio (Na) con carga +1: Número atómico 11. Como es un catión con carga +1, tiene 11 – 1 = 10 electrones.
- Cloro (Cl) con carga -1: Número atómico 17. Como es un anión con carga -1, tiene 17 + 1 = 18 electrones.
Cómo usar la tabla periódica para encontrar el número de electrones
La tabla periódica es una herramienta esencial para identificar rápidamente el número atómico de un elemento, que corresponde a la cantidad de protones y, en un átomo neutro, a la cantidad de electrones. El número atómico se encuentra generalmente en la parte superior o inferior del símbolo del elemento en cada casillero.
Por ejemplo, el hidrógeno (H) tiene número atómico 1, por lo que tiene 1 electrón cuando es neutro. El hierro (Fe) posee número atómico 26, por lo que en un estado neutro tiene 26 electrones.
Consideraciones adicionales
Es importante destacar que el número de electrones puede variar si el átomo forma un ion o participa en enlaces químicos. Además, en los casos de isotopos, el número de protones y electrones permanece igual (en átomos neutros), pero cambia el número de neutrones.
Con esta información, podrás determinar fácilmente cuántos electrones tiene cualquier elemento químico, sea en estado neutro o iónico, utilizando su número atómico y el conocimiento básico de cargas eléctricas.
Métodos prácticos para identificar la cantidad de electrones en un átomo
Para descubrir cuántos electrones tiene un átomo, existen diversas técnicas y enfoques que combinan tanto el análisis teórico como el experimental. Comprender estos métodos es fundamental para estudiantes, investigadores y profesionales que trabajan en química, física y ciencias de materiales.
1. Uso de la tabla periódica para determinar electrones
El método más común y accesible para identificar la cantidad de electrones en un elemento es consultar su ubicación en la tabla periódica. Esta herramienta organiza los elementos según su número atómico, que equivale a la cantidad de protones y, en un átomo neutro, también al número de electrones.
- Ejemplo: El oxígeno tiene número atómico 8, por lo tanto, un átomo neutro de oxígeno posee 8 electrones.
- Consejo práctico: En átomos neutros, el número atómico siempre coincide con la cantidad de electrones.
2. Configuración electrónica mediante modelos atómicos
Otra forma de identificar la cantidad y distribución de los electrones es mediante la configuración electrónica. Este método asigna a cada átomo una distribución específica de electrones en diferentes niveles y subniveles de energía.
- La configuración se representa con números y letras, por ejemplo, 1s² 2s² 2p⁴ para el oxígeno.
- Este esquema permite entender no sólo cuántos electrones hay, sino cómo están organizados, lo que es vital para predecir la reactividad química.
Dato interesante: El elemento con mayor número de electrones estable conocido es el oganesón (Z=118), con 118 electrones.
3. Espectroscopía electrónica para medir electrones
En laboratorios especializados, se utiliza la espectroscopía electrónica para determinar características de los electrones en un átomo. Técnicas como la espectroscopía de fotoelectrones (XPS) analizan la energía que se requiere para extraer electrones, proporcionando información sobre la cantidad y distribución electrónica.
- Esta técnica es especialmente útil para materiales y elementos en estado sólido o compuestos.
- Aplicación práctica: Se usa en la industria de semiconductores para caracterizar la pureza y propiedades electrónicas de materiales.
4. Cálculos y simulaciones computacionales
Los avances en química computacional permiten calcular la cantidad y comportamiento de electrones en átomos y moléculas mediante programas específicos.
- Estos cálculos utilizan principios de la mecánica cuántica para estimar distribuciones electrónicas.
- Se emplean en el diseño de fármacos, materiales nanométricos y en la investigación de nuevas moléculas.
Consejo para estudiantes: Familiarizarse con software como Gaussian o Quantum ESPRESSO puede abrir puertas a investigaciones avanzadas sobre electrones.
Tabla comparativa de métodos para identificar electrones
| Método | Ventajas | Limitaciones | Aplicación típica |
|---|---|---|---|
| Tabla periódica | Rápido, sencillo y accesible | Solo para átomos neutros | Educación básica y química general |
| Configuración electrónica | Información detallada sobre distribución electrónica | Requiere conocimiento previo | Química avanzada y predicción de reactividad |
| Espectroscopía electrónica | Medición experimental precisa | Equipamiento costoso y especializado | Industria y laboratorios de investigación |
| Simulaciones computacionales | Permite estudiar situaciones complejas | Requiere conocimientos técnicos y computacionales | Investigación avanzada y diseño molecular |
Preguntas frecuentes
¿Qué es un electrón?
Un electrón es una partícula subatómica con carga negativa que orbita el núcleo del átomo.
¿Cómo se determina la cantidad de electrones en un átomo neutro?
En un átomo neutro, el número de electrones es igual al número atómico, que es la cantidad de protones.
¿Qué pasa si el elemento es un ion?
Si es un ion, se suman o restan electrones según la carga del ion: carga positiva resta electrones, carga negativa suma.
¿Dónde puedo encontrar el número atómico de un elemento?
El número atómico se encuentra en la tabla periódica, generalmente ubicado arriba del símbolo del elemento.
¿Los isótopos tienen diferente cantidad de electrones?
No, los isótopos varían en neutrones, pero en estado neutro tienen la misma cantidad de electrones que protones.
¿Cómo afecta la cantidad de electrones las propiedades del elemento?
La cantidad de electrones determina la reactividad y las propiedades químicas del elemento.
| Punto Clave | Descripción |
|---|---|
| Número Atómico (Z) | Indica la cantidad de protones y, en estado neutro, también de electrones. |
| Elemento Neutro | El número de electrones es igual al número atómico. |
| Iones | Electrones varían según la carga: anión (+electrones), catión (-electrones). |
| Tabla Periódica | Herramienta principal para identificar número atómico y otros datos del elemento. |
| Isótopos | Tienen diferente cantidad de neutrones, pero la misma carga eléctrica en estado neutro. |
| Electrones y Reactividad | Los electrones de valencia definen cómo interactúa el átomo con otros. |
Dejá tus comentarios y no te pierdas otros artículos interesantes en nuestra web para seguir aprendiendo sobre química y ciencias.